Bases
moleculares e celulares do tumor
Last full review/revision July
2018 by Robert Peter Gale, MD, PhD
Muitos
fatores estão envolvidos na causa e na permissão da proliferação desregulada
das células que ocorre no câncer.
Cinética celular
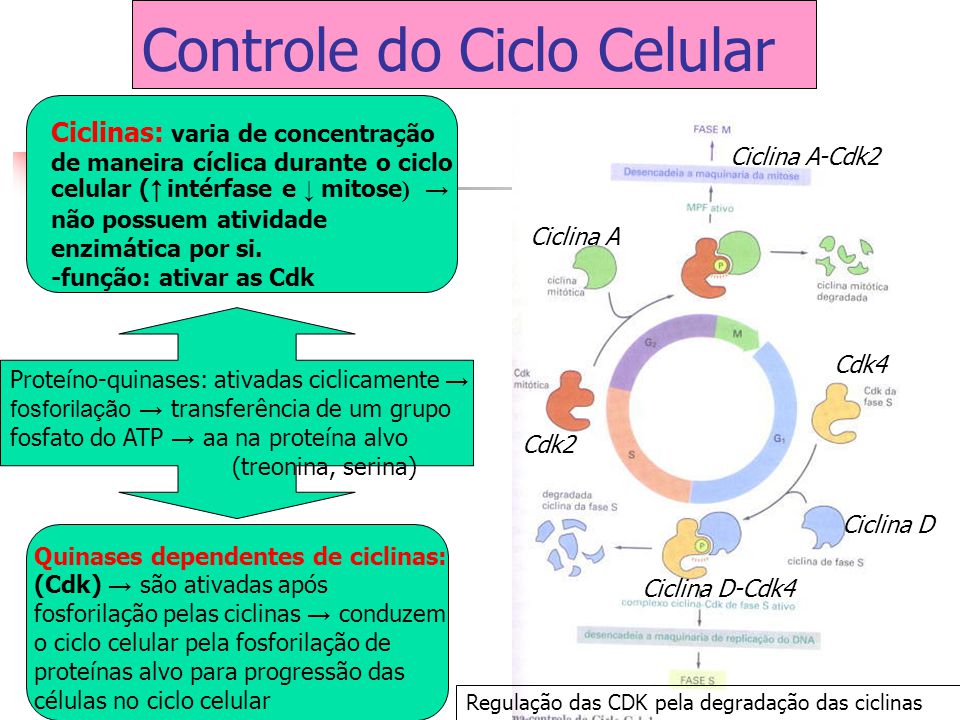
O tempo de geração é o tempo necessário para a célula
quiescente completar um ciclo de divisão celular (ver figura Ciclo
celular) e originar 2 células-filhas. As células malignas,
particularmente aquelas que surgem da médulo óssea ou sistema linfático, podem
ter um tempo de geração mais curto, e normalmente há uma porcentagem menor de
células em G0 (fase estacionária). O crescimento tumoral
inicial exponencial é seguido por uma fase platô em que a morte celular
equivale à taxa de formação das células-filhas. A diminuição da taxa de
proliferação pode estar relacionada à exaustão do fornecimento de nutrientes e
oxigênio para a rápida expansão do tumor. Quando comparados a tumores maiores,
os tumores menores têm maior porcentagem de células ativas.
Uma
subpopulação com vários tumores, identificada por proteínas de superfície, pode
ter as propriedades das células-tronco primitivas "normais", como
encontrado no embrião em estágio inicial. Assim, essas células podem passar
para o estado proliferativo. Elas são menos sensíveis a lesões por fármacos ou
irradiação. Acredita-se que elas repovoem os tumores depois da radioterapia,
quimioterapia ou cirurgia.
A cinética
celular de certos tumores é uma consideração importante ao planejar os regimes
medicamentosos antineoplásicos e pode influenciar os cronogramas de dosagem e
intervalos de tempo do tratamento. Muitos antineoplásicos, como antimetabólitos,
são mais eficazes quando as células estão se dividindo ativamente e alguns
fármacos só funcionam durante uma fase específica do ciclo e, assim, requerem
administração prolongada para atingir as células que estão se dividindo durante
a fase de maior sensibilidade.
Crescimento tumoral e metástase
À medida que o tumor
cresce, os nutrientes são fornecidos por difusão direta da circulação. O
crescimento local é facilitado pelas enzimas (p. ex., proteases) que
destroem os tecidos adjacentes. À medida que o volume do tumor aumenta, são
produzidos fatores angiogênicos tumorais, como o fator de crescimento
endotelial vascular (VEGF), que formam o suprimento vascular necessário para o
crescimento tumoral posterior.
Desde
seu início, um tumor pode liberar células na circulação. Partindo de modelos
animais, estima-se que um tumor de 1 cm libere > 1 milhão de células em 24 h na
circulação venosa. As células tumorais circulantes estão presentes em muitos
pacientes com câncer avançado e mesmo em alguns com doença localizada. Embora a
maioria das células tumorais circulantes morra no espaço intravascular, uma
célula ocasional adere ao endotélio vascular e penetra os tecidos circundantes,
gerando tumores independentes (metástases) em locais distantes. Os tumores
metastáticos crescem bastante da mesma forma que os tumores primários e podem,
subsequentemente, dar origem a outras metástases.
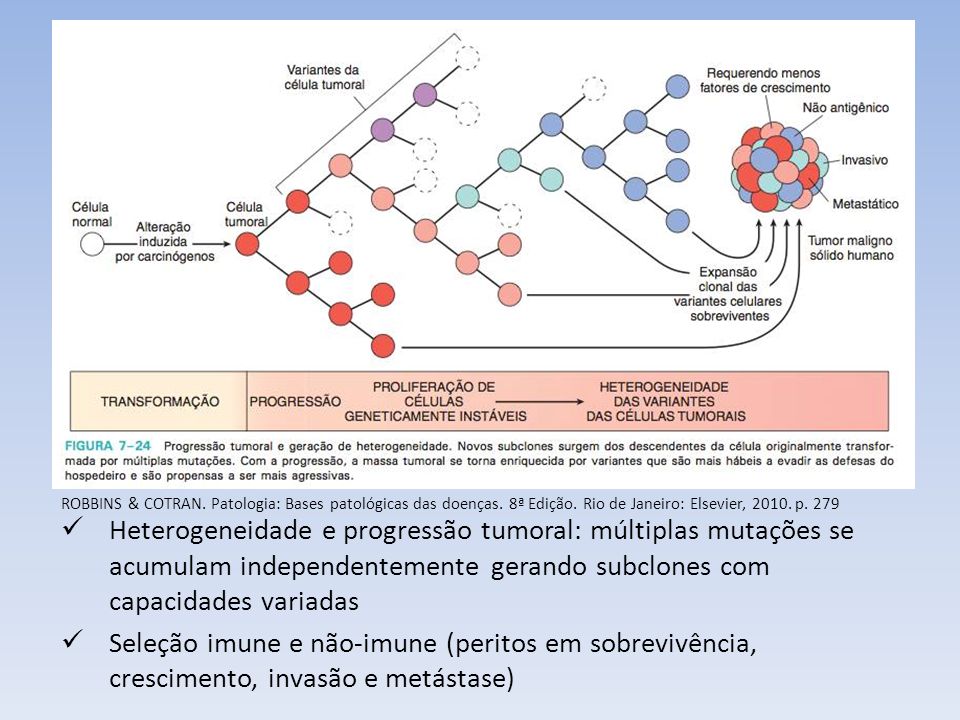
Experimentos sugerem que
as habilidades de invadir, migrar, implantar e estimular com sucesso o
crescimento de novos vasos sanguíneos sejam propriedades importantes das
células metastáticas, que provavelmente representam um subconjunto das células
existentes no tumor primário.
O
sistema imunitário e o câncer
As células malignas
tipicamente apresentam antígenos que são interpretáveis como "não
próprios" pelo sistema imunitário. Muitas vezes, isso leva à destruição
das células malignas como ocorre com qualquer invasor. Essa destruição pode ser
completa e, nesse caso, o câncer nunca aparece. Entretanto, algumas células
malignas têm ou adquirem a capacidade de evitar a detecção e/ou destruição pelo
sistema imunitário, possibilitando a sua proliferação.
Embora
o sistema imunitário obviamente tenha um papel protetor, não está claro por que
as pessoas com deficiências
imunitárias congênitas ou adquiridas apresentam maior risco de
ter apenas determinados tipos de câncer comuns (p. ex., melanoma, carcinoma de
células renais ou linfoma) e não outros (p. ex., câncer de pulmão, mama,
próstata ou cólon). Uma consideração é ter havido pouca pressão evolutiva
seletiva para refinar a resposta imunitária aos tipos de câncer que ocorrem
após a idade reprodutiva.
Por
outro lado, as células malignas têm forte pressão evolutiva para criar
mecanismos para escapar do sistema imunitário. Um desses mecanismos de defesa é
a mimetização das células normais pela expressão de proteínas de pontos de
checagem (checkpoint). As proteínas do ponto de checagem são
moléculas da superfície celular que sinalizam para as células T circulantes que
a célula que as contêm é normal e não deve ser atacada. Um exemplo é a proteína
PD-L1, que é reconhecida pela molécula PD-1 nas células T; quando a PD-L1 se
liga à PD-1 em uma célula T, essa célula não ataca. O tratamento contra o
câncer utilizando anticorpos monoclonais para bloquear o PD-L1 ou a PD-1
(denominados inibidores do ponto de checagem) pode assim permitir que o sistema
imunitário ataque as células cancerosas antes protegidas pela proteína PD-L1. A
CTLA-4 é outra proteína de ponto de checagem que impede o ataque do sistema
imunitário e que também pode ser bloqueada por um anticorpo. Como as proteínas
de ponto de checagem podem existir em células normais, o tratamento com o
inibidor de ponto de checagem também pode induzir o sistema imunitário a atacar
essas células.
Outro avanço importante
na terapia imunológica é o uso de células T geneticamente modificadas [chamada
terapia de células T de receptor de antígeno quimérico (CAR-T)]. Nesse
processo, as células T são removidas de um paciente e modificadas geneticamente
para expressar receptores que contêm um domínio de reconhecimento de um
antígeno tumoral específico acoplado a domínios de sinalização intracelular que
ativam a célula T. Quando as células T modificadas são reinfundidas, podem
atacar as células que contêm esse antígeno tumoral específico.
Anormalidades
moleculares
As mutações genéticas são
responsáveis pela geração de células neoplásicas e, portanto, estão presentes
em todos os cânceres. Essas mutações alteram a quantidade ou a função dos
produtos proteicos que regulam o crescimento e a divisão celulares e o reparo
de DNA. As duas principais categorias de genes mutados são
·
Oncogenes
·
Genes supressores de tumor
Oncogenes
Oncogenes são formas
anômalas de genes normais (proto-oncogenes) que regulam os vários aspectos do
crescimento e da diferenciação celulares. A mutação desses genes pode resultar
no estímulo contínuo e direto das vias biológicas moleculares (p. ex., receptores
do fator de crescimento da superfície celular, vias de transdução do sinal
intracelular, fatores de transcrição, fatores de crescimento secretados) que
controlam o crescimento e a divisão celulares, metabolismo celular, reparo de
DNA, angiogênese e outros processos fisiológicos.
Há > 100 oncogenes conhecidos que
podem contribuir para a transformação neoplásica humana. Por exemplo, o gene RAS codifica a
proteína ras, que transporta os sinais dos receptores ligados à membrana até a
via RAS-MAPKinase ao núcleo da célula, e assim regula a divisão celular. As
mutações podem resultar na ativação inapropriada da proteína ras, causando
crescimento celular descontrolado. A proteína ras é anormal em cerca de 25% dos
cânceres humanos.
Outros oncogenes têm sido
implicados em tipos específicos de câncer. Esses incluem
·
HER2 (amplificado
no câncer de mama e gástrico e menos comumente no câncer de pulmão)
·
BCRABL1 (uma
translocação de 2 genes subjacentes à leucemia mielóide crônica e algumas
leucemias linfocíticas de células B)
·
CMYC (linfoma
de Burkitt)
·
NMYC (câncer
de pulmão de células pequenas, neuroblastoma)
·
EGFR (adenocarcinoma
do pulmão)
·
EML4ALK (translocação
que ativa a quinase da tirosina ALK e causa uma forma única de adenocarcinoma
de pulmão)
Oncogenes específicos
podem ter implicações importantes para diagnóstico, terapia e prognóstico (ver
discussões individualizadas de cada tipo específico de câncer).
Oncogenes normalmente
resultam de
·
Mutações pontuais de células somáticas adquiridas (p. ex.,
decorrente de carcinogênicos químicos)
·
Amplificação gênica (p. ex., aumento no número de cópias
de um gene normal)
·
Translocações (nas quais partes de diferentes genes se
fundem formando uma sequência única)
Essas alterações podem
aumentar a atividade do produto gênico (proteína) ou alterar sua função.
Ocasionalmente, a mutação nos genes das células germinativas resulta em herança
da predisposição ao câncer.
Os
genes como TP53, BRCA1 e BRCA2 desempenham um
papel na divisão celular normal e no reparo do DNA e são cruciais na detecção
de sinais de crescimento inapropriado ou dano ao DNA nas células. Se esses
genes, como resultado de mutações adquiridas ou herdadas, são incapazes de
funcionar, o sistema para monitorar a integração do DNA é ineficiente, células
com as mutações genéticas espontâneas persistem ou proliferam, o resultado é o
aparecimento de tumores.
Como
na maioria dos genes, 2 alelos estão presentes para codificar cada gene
supressor de tumor. Uma cópia defeituosa de um gene pode ser herdada, deixando
a pessoa com somente um alelo funcional para o gene supressor de tumor
individual. Se uma mutação é adquirida no alelo
funcional, é perdido o mecanismo protetor normal do 2º gene supressor de tumor.
A
proteína reguladora importante, a p53, impede a replicação do DNA lesado em
células normais e promove a morte celular (apoptose) em células com DNA
anormal. Uma p53 inativa ou alterada permite que células com DNA anormal
sobrevivam e se dividam. As mutações TP53 são passadas para as células-filhas,
conferindo alta probabilidade de replicação de DNA suscetível a erros, e o
resultado é transformação neoplásica. TP53 é defeituoso em vários tipos de câncer
humano.
Mutações
no BRCA1 e BRCA2 que diminuem a
função aumentam o risco de câncer de mama e de ovário.
Outro
exemplo, o gene para retinoblastoma (RB) codifica a proteína Rb, que regula o ciclo celular,
interrompendo a replicação do DNA. As mutações do gene RB ocorrem em muitos
tipos de câncer humano, permitindo que as células afetadas dividam-se
continuamente.
Da
mesma forma que com os oncogenes, a mutação dos genes supressores do tumor como TP53 ou RB de células
germinativas pode resultar em transmissão vertical e em maior incidência de
câncer nos descendentes.
Anomalias
cromossômicas podem ocorrer por deleção, translocação ou
duplicação. Se essas alterações ativarem ou inativarem genes que resultam em
vantagem proliferativa sobre as células normais, então pode haver
desenvolvimento de um câncer. Anormalidades cromossômicas acontecem na maioria
dos cânceres humanos. Em algumas doenças congênitas (síndrome de Bloom, anemia
de Fanconi, síndrome de Down), os processos de reparo do DNA estão defeituosos
e os cromossomos se rompem com frequência, colocando as crianças em grande
risco de leucemia aguda e linfomas.
A
maioria dos cânceres epiteliais provavelmente resulta das mutações que levam à
conversão neoplásica. Por exemplo, o câncer de colo na polipose familiar ocorre
por meio de uma sequência de eventos genéticos: hiperproliferação epitelial
(perda de um gene supressor no cromossomo 5), adenoma precoce (alteração na
metilação do DNA), adenoma intermediário (excesso de atividade do oncogene RAS), adenoma tardio
(perda de um gene supressor no cromossomo 18) e, por fim, câncer (perda de um
gene no cromossomo 17). Alterações genéticas posteriores podem ser necessárias
para as metástases.
Telômeros: São complexos
nucleoproteicos que cobrem as terminações dos cromossomos e mantêm sua
integridade. No tecido normal, o encurtamento do telômero (que ocorre com a
idade) resulta em divisão celular sem limites. A enzima telomerase, se ativada
em células tumorais, possibilita nova síntese dos telômeros e permite a
proliferação tumoral contínua.
Infecções
Os vírus contribuem para a patogenia dos tumores
humanos (ver tabela Vírus
associados ao câncer). A patogênese pode ocorrer por meio da
integração de elementos genéticos virais no DNA hospedeiro. Esses novos genes
são expressos pelo hospedeiro; podem afetar o crescimento ou a divisão celular,
ou romper os genes hospedeiros normais necessários para o controle do
crescimento e da divisão celular. Por outro lado, a infecção viral pode
resultar em disfunção imunitária, causando diminuição da vigilância imunitária
para tumores iniciais. A infecção pelo HIV aumenta o risco de alguns tipos de
câncer (ver Tipos de
câncer comuns nos pacientes infectados pelo HIV).
Bactérias também
podem ocasionar câncer. Infecção por Helicobacter
pylori eleva o risco de vários tipos de câncer (adenocarcinoma
gástrico, linfoma gástrico, MALT).
Alguns
tipos de parasitas podem provocar câncer. Schistosoma haematobium causa inflamação e
fibrose crônicas da bexiga, o que pode acarretar câncer. Opisthorchis sinensis tem sido ligado ao
carcinoma de pâncreas e ductos biliares.
Radiação
A radiação ultravioleta pode induzir câncer de
pele (p. ex., carcinoma de células escamosas e basocelular, melanoma), lesando
o DNA. Esse dano no DNA consiste na formação de dímeros de timidina, que podem
escapar à excisão e provocar nova síntese da fita de DNA. Pacientes com
defeitos inerentes no reparo do DNA (p. ex., xeroderma pigmentoso) ou supressão
imunitária por fármacos ou doenças subjacentes são particularmente propensos ao
câncer de pele decorrente da exposição aos raios ultravioleta.
A radiação ionizante também é carcinogênica. Por
exemplo, os sobreviventes das explosões das bombas atômicas de Hiroshima e
Nagasaki têm incidência maior do que a esperada de leucemia e outros cânceres.
Do mesmo modo, a exposição à radioterapia pode causar leucemia, câncer de mama,
sarcoma e outros tipos de câncer sólidos anos após a exposição. Considera-se
que a exposição aos raios X para exames de imagem diagnósticos pode aumentar o
risco de câncer (ver Riscos da irradiação
médica). A exposição industrial (p. ex., ao urânio pelos mineiros)
está ligada ao câncer de pulmão após uma latência de 15 a 20 anos. A exposição
a longo prazo à irradiação ocupacional ou ao depósito interno de dióxido de
tório predispõe as pessoas aos angiossarcomas e à leucemia não linfocítica
aguda.
O radônio, gás radioativo liberado do solo,
aumenta o risco de câncer de pulmão, especialmente entre os fumantes.
Normalmente, o radônio se dispersa rápido na atmosfera e não causa danos.
Entretanto, quando uma construção é feita em solo com alto conteúdo de radônio,
este pode se acumular, produzindo, às vezes, altos níveis no ar, suficientes
para provocar problemas. Em pessoas expostas e que também fumam, o risco de
câncer de pulmão é ainda maior.
Fármacos
e substâncias químicas
Estrógenos contidos
nos contraceptivos orais podem elevar levemente o risco de câncer de mama, mas
esse risco diminui com o tempo. Estrógeno e progestina usados na
terapia de reposição hormonal também aumentam o risco de câncer de mama.
O dietilestilbestrol
(DES) aumenta o risco de câncer de mama nas mulheres que tomam este fármaco e
eleva o risco de câncer vaginal nas filhas dessas mulheres expostas antes do
nascimento.
O uso a longo prazo de
esteroides anabólicos pode aumentar o risco de câncer de fígado.
O tratamento do câncer
somente com quimioterápicos ou radioterapia aumenta o risco do desenvolvimento
de um segundo câncer, bem como os imunossupressores administrados para
transplante de órgãos.
Os
carcinogênicos químicos podem induzir mutações genéticas e resultar em
crescimento descontrolado e formação tumoral (ver tabela Carcinógenos
químicos comuns). Outras substâncias, chamadas cocarcinogênicas,
possuem pouco ou nenhum potencial carcinogênico inerente, mas estimulam o
efeito carcinogênico de outro agente quando expostos simultaneamente.
Substâncias alimentares
Certas substâncias
consumidas na dieta podem elevar o risco de câncer. Por exemplo, uma dieta rica
em gordura tem sido associada a maior risco de câncer de cólon, mama e,
possivelmente, próstata. Pessoas que ingerem grande quantidade de álcool têm
maior risco de ter câncer, como câncer de cabeça e pescoço e câncer de esôfago.
Dieta rica em alimentos defumados e em conserva ou carnes cozidas em
temperatura alta aumenta o risco de câncer de estômago. Pessoas com excesso de
peso ou obesas têm maior risco de câncer de mama, endométrio, cólon, rim e
esôfago.
Fatores físicos
Inflamação crônica de
pele, pulmão, trato gastrointestinal ou tireoide podem predispor ao
aparecimento de um câncer. Por exemplo, pacientes com doença intestinal
inflamatória de longa duração (colite ulcerativa) têm maior risco de carcinoma
colorretal. Exposição à luz solar e à luz de bronzeamento aumenta o risco de
câncer de pele e melanoma.
A disfunção do sistema
imunitário como resultado de mutação genética herdada, doenças adquiridas,
envelhecimento ou fármacos imunossupressores interfere na vigilância
imunológica normal dos tumores precoces e resulta maior incidência de câncer.
Os distúrbios imunitários conhecidos associados ao câncer incluem
·
Ataxia-telangiectasia (leucemia
linfocítica aguda [ALL], tumores cerebrais, câncer gástrico)
·
Síndrome de Wiskott-Aldrich (linfoma, ALL)
·
Agamaglobulinemia
ligada ao cromossomo X (linfoma, ALL)
·
Deficiência imunitária decorrente de fármacos
imunossupressores ou da infecção pelo HIV (linfoma de células grandes, câncer
cervical, câncer de cabeça e pescoço, sarcoma de Kaposi)
·
Doenças reumatológicas, como LES, AR e síndrome de Sjögren (linfoma de células
B)
Comentários
Postar um comentário